Wasser Biologie – Definition
Wasser, auch bekannt unter der Formel H2O, ist eine chemische Verbindung aus Wasserstoff (H) und elementaren Sauerstoff (O).
Die Besonderheiten des Wassers sind auf seine Atomgruppierungen und die damit verbundene räumliche Struktur zurückzuführen.
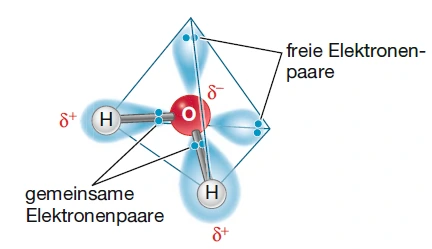
Abbildung 1: Räumliche Struktur des Wassers, Quelle: Springer
Sauerstoff besitzt eine Elektronegativität von 3,5, wobei Wasserstoff lediglich den Wert 2,1 trägt. Diese relativ hohe Differenz hat zur Folge, dass die gemeinsamen Elektronenpaare von Sauerstoff und Wasserstoff sich häufiger in der Nähe von dem Sauerstoffatom aufhalten: Die Ladungen sind unterschiedlich verteilt (Ladungsasymmetrie).
Elektronennegativität ist ein relatives Maß, das beschreibt, wie stark ein Atom Elektronen zum Kern zieht. Je höher der Wert, desto stärker die Anziehung.
Dadurch trägt das Sauerstoffatom eine negative Partialladung – gekennzeichnet mit ![]() – und die Wasserstoffatome eine positive Partialladung – dargestellt mit
– und die Wasserstoffatome eine positive Partialladung – dargestellt mit ![]() . Hinzu kommt, dass Wasser räumlich gewinkelt ist. Die Wasserstoffatome und die freien Elektronenpaare des Sauerstoffatoms zeigen in die Ecken eines gedachten Tetraeders. Dadurch findet man im Molekül eine negative Partialladung (
. Hinzu kommt, dass Wasser räumlich gewinkelt ist. Die Wasserstoffatome und die freien Elektronenpaare des Sauerstoffatoms zeigen in die Ecken eines gedachten Tetraeders. Dadurch findet man im Molekül eine negative Partialladung (![]() ) am Sauerstoffatom und eine kombinierte positive Partialladung (
) am Sauerstoffatom und eine kombinierte positive Partialladung (![]() ) zwischen den Wasserstoffatomen. Damit wird Wasser polar.
) zwischen den Wasserstoffatomen. Damit wird Wasser polar.
Eine chemische Verbindung wird polar genannt, wenn sich aufgrund von Ladungsverschiebungen im Molekül getrennte Ladungsschwerpunkte bilden. Ein polarer Stoff (z. B. Glucose) löst sich gut in anderen polaren Stoffen (z. B. Wasser), in unpolaren Stoffen (z. B. Benzin) allerdings weniger gut oder gar nicht.
Wasser besitzt zwar ein Dipol, trägt allerdings keine elektrische Ladung wie bspw. das Kation Na+. Es hat einen positiven und negativen Pol, ist aber als Molekül gesamt neutral, d. h. nicht geladen.
Doch warum ist diese Raumstruktur von Wasser von herausragender Bedeutung?
Besondere Eigenschaften von Wasser
Die besondersten Eigenschaften des Wassers sind primär auf die Fähigkeit zur Ausbildung von Wasserstoffbrückenbindungen zurückzuführen.
Eine Wasserstoffbrückenbindung (kurz Wasserstoffbrücke oder H-Brücke) ist eine elektrostatische Anziehungskraft, die zwischen Molekülen mit kovalent gebundenen H-Atomen ausgebildet werden kann.
Das Wasserstoffatom muss an ein Atom mit hoher Elektronennegativität gebunden sein, wie z. B. Stickstoff (N), Sauerstoff (O) oder Fluor (F). Der wechselwirkende Partner muss allerdings wiederum ein freies Elektronenpaar besitzen.
 Abbildung 2: Wasserstoffbrückenbindung zwischen zwei Wassermolekülen; Quelle: Wikipedia.de
Abbildung 2: Wasserstoffbrückenbindung zwischen zwei Wassermolekülen; Quelle: Wikipedia.de
Die Ausbildung von H-Brücken beeinflusst maßgeblich die Aggregatzustände von Wasser.
Aggregatzustände des Wassers
Wasser ist der einzige Stoff auf der Erde, der in allen drei üblichen Aggregatzuständen in großer Menge vorkommt. Sei es als Eis an den Polarkappen, in flüssiger Form in den Weltmeeren oder als Wasserdampf in der Atmosphäre. Wasser vollführt zu bestimmten Temperaturen einen Wechsel seiner Aggregatzustände.
Wasser stellt damit auch die Basis für die bekannte Temperatureinheit °C dar.
Wasser besitzt unter Standardbedingungen (Druck von 1013,25 hPa) seinen Schmelzpunkt bei 0 °C und seinen Siedepunkt bei 100 °C.
 Abbildung 3: Ein “Smaragdeisberg” in der Antarktis. Quelle: nationalgeographic.de
Abbildung 3: Ein “Smaragdeisberg” in der Antarktis. Quelle: nationalgeographic.de
Wenn Du mehr über Aggregatzustände erfahren möchtest, dann schau' doch mal beim Artikel “Aggregatzustand” vorbei.
Wasser ist ein kleines Molekül. Ungewöhnlich ist allerdings, dass andere Stoffe vergleichbarer Größe deutlich weniger Energie benötigen, um einen gewissen Aggregatzustand zu erreichen. So liegt Methan schon bei -162 °C gasförmig vor. Warum benötigt Wasser so viel mehr Wärme?
Spezifische Wärmekapazität des Wassers
Die spezifische Wärmekapazität beschreibt die Fähigkeit eines Stoffes, thermische Energie, also Wärme, zu speichern. Sie wird allgemein als Energie angegeben, die benötigt wird, um 1g eines Stoffes um 1 °C zu erwärmen.
Flüssiges Wasser besitzt eine spezifische Wärmekapazität von etwa ![]() pro °C. Das ist vergleichsweise hoch. Um bspw. dieselbe Menge Sand um ein °C zu erwärmen, braucht man lediglich ein Fünftel der Energie. Auch die Energie, die man zum Wechsel der Aggregatzustände benötigt, ist enorm. Um ein Kilogramm Wasser zu schmelzen braucht man etwa 333 kJ, um es zu verdampfen sogar 2257 kJ!
pro °C. Das ist vergleichsweise hoch. Um bspw. dieselbe Menge Sand um ein °C zu erwärmen, braucht man lediglich ein Fünftel der Energie. Auch die Energie, die man zum Wechsel der Aggregatzustände benötigt, ist enorm. Um ein Kilogramm Wasser zu schmelzen braucht man etwa 333 kJ, um es zu verdampfen sogar 2257 kJ!
“J” steht für die Energieeinheit Joule. 1 J entspricht definitionsgemäß der Energie, die benötigt wird, um die Kraft von 1 Newton über einen Meter auszuüben. Ebenso kann es als Arbeit definiert werden: 1 J beschreibt auch die Energie, um eine Leistung von 1 Watt in einer Sekunde auszuführen. “k” vor der Einheit ist eine Abkürzung für kilo und entspricht dem Wert 1000. 1 kJ sind folglich 1000 J.
Der Grund für diese hohen Energiewerte sind die Wasserstoffbrückenbindungen zwischen den Molekülen im Wasser. Im Eis halten die H-Brücken die Moleküle an Ort und Stelle und bilden eine charakteristische hexagonale Gitterstruktur.
Im flüssigen Wasser werden die Wasserstoffbrücken fortwährend gebildet und wieder gebrochen. Chemiker schätzen, dass die Bildung und der Bruch von H-Brücken an einem Wassermolekül ungefähr eine Billion Mal in einer Minute stattfinden. Im gasförmigen Zustand bildet Wasser keine Wasserstoffbrückenbindungen.
Eine umfassendere Erklärung zum Zusammenhang zwischen Temperatur und Wärme findest Du im Artikel “Temperatur und Wärme”.
 Abbildung 4: Wasserstoffbrückenbildung des Wassers in seinen Aggregatzuständen. Quelle: Springer
Abbildung 4: Wasserstoffbrückenbildung des Wassers in seinen Aggregatzuständen. Quelle: Springer
Je mehr Wasser abgekühlt wird, desto schwerer wird es. Kaltes Wasser sinkt also zum Grund eines Gewässers. Warum aber, schwimmt nun Eis auf dem Wasser und geht nicht unter?
Das liegt an der Dichteanomalie des Wassers. Seine höchste Dichte besitzt Wasser nicht bei 0 °C, sondern bei etwa +4 °C. In Abbildung 4 kannst Du die Kristallstruktur des Wassers im Eis erkennen. Der Abstand der Wassermoleküle im Eis ist größer als der Moleküle im flüssigen Wasser. Diese Dichteanomalie ist für das Leben wichtig.
Genaueres dazu erfährst Du im Artikel “Anomalie des Wassers”.
Bedeutung des Wassers
Eis schwimmt oben. Warum ist das wichtig? Stell Dir einmal vor, Wasser würde sich nicht so verhalten.
Auf welche Art und Weise würde nun ein See im Winter gefrieren?
Das Eis, dass sich an der Oberfläche kontinuierlich bildet, würde immer wieder absinken, bis der gesamte See zugefroren wäre. Lebewesen im See könnten sich nicht im Wasser vor dem Gefrieren schützen und würden Winter für Winter sterben. Da nun allerdings Eis oben schwimmt, bildet es eine isolierende Schicht. Die Tiere und Pflanzen können am Grund des Sees in etwa 4 °C kalten Wasser überleben und den Winter überdauern.
Die hohe spezifische Wärmekapazität ist ebenso für unser Überleben wichtig. Große Wassermassen, wie Ozeane, Seen und Flüsse, nehmen im Sommer viel Energie auf, geben allerdings auch im Winter viel Energie ab. Der warme Golfstrom bspw. mildert das Klima in Europa.
 Abbildung 5: Verlauf des Golfstroms im Atlantik. Quelle: de.wikipedia.org
Abbildung 5: Verlauf des Golfstroms im Atlantik. Quelle: de.wikipedia.org
Wenn Du mehr über die globalen Meeresströmungen erfahren möchtest, dann ließ Dir doch den Artikel “Meeresströmungen” durch!
Die hohe Verdampfungswärme des Wassers spürst Du beim Schwitzen. Dein Schweiß verdunstet und entzieht die hierfür benötigte Energie aus der Umgebung, aus Deinem Körper.
Wasser Biologie - Kohäsion und Adhäsion
Flüssiges Wasser bildet und bricht kontinuierlich Wasserstoffbrücken. Dadurch entsteht ein gewisser Zusammenhalt der Moleküle im Wasser. Das bezeichnet man als Kohäsion. Adhäsion hingegen tritt bei Kontakt mit Wasser und mit der Oberfläche eines anderen Feststoffes auf.
Kohäsion beschreibt die Anziehungskraft von Molekülen untereinander in demselben Stoff.
Adhäsion ist die Anziehungskraft von Molekülen in einer Flüssigkeit zu einem anderen Feststoff.
Die Eigenschaft der Kohäsion und der Adhäsion kannst Du an Wassertropfen auf Blättern beobachten:
 Abbildung 6: Wassertropfen auf einem Pflanzenblatt
Abbildung 6: Wassertropfen auf einem Pflanzenblatt
Die Kohäsion des Wassers hält die Moleküle in größeren Tropfen zusammen, die Adhäsion tritt beim Kontakt des Wassers mit der Blattoberfläche hervor. Wenn Du genau hinschaust, kannst Du sogar in Abbildung 6 die leichte Krümmung des Wassers zum Blatt am größten Tropfen erkennen.
Mehr zu dem Phänomen der Kohäsion und Adhäsion kannst Du in den jeweiligen Artikeln “Kohäsion (Chemie)” und “Adhäsion (Chemie)” nachlesen.
Biologische Bedeutung von Wasser für Pflanzen
Pflanzen machen sich die Kohäsions- und Adhäsionseigenschaft von Wasser beim Transport zunutze. Sie benötigen Wasser für die Photosynthese, die in den Chloroplasten in den Blättern stattfindet. Nun stelle Dir einmal vor, ein 30 Meter hoher Eichenbaum müsste immer Energie aufbringen, um Wasser, Mineralien und andere Stoffe aus den Wurzeln zum Baumwipfel zu transportieren. Er müsste die Höhenenergie von mehr als zehn Stockwerken überwinden!
Darum besitzen Pflanzen hierfür eine elegante Lösung unter Ausnutzung der Eigenschaften des Wassers. Pflanzen bilden dünne Wassersäulen von den Wurzeln zu den Blättern. Wenn bspw. nun der Eichenbaum Wasser an den Blättern verdunsten lässt, so wird die gesamte Wassersäule durch die verdunstenden Wassermoleküle nach oben “gezogen”. Auch in Wasser gelöste Stoffe, wie Mineralien, können so in die Wipfel des Baumes transportiert werden.
 Abbildung 7: Transport von Wasser in einer Pflanze. Quelle: hauswirtschaft.info
Abbildung 7: Transport von Wasser in einer Pflanze. Quelle: hauswirtschaft.info
Biologische Bedeutung von Wasser für Insekten
Auch Insekten nutzen die Kohäsions- und Adhäsionseigenschaften aus. Insekten sind deutlich kleiner, weswegen diese Kräfte für sie gravierender sind, als für größere Organismen wie den Menschen.
So kann bspw. der Wasserläufer die Oberflächenspannung des Wassers (ein Ergebnis der Kohäsion) zur Fortbewegung nutzen. Eine Biene hingegen kann von Wasser regelrecht gefangen werden. Sie kann sich dann nicht mehr aus dem Wasser befreien, da sie die Kräfte des Wassers nicht überwinden kann. Der Wasserläufer setzt gerade darauf, dass andere Insekten in z. B. einen Teich fallen und sich nicht mehr befreien können. Ist das Insekt nun auf der Wasseroberfläche “gestrandet”, kann der Wasserläufer sie nun leicht erbeuten.
Wasser - Lösungsmittel
Da Wasser ein polarer Stoff ist, kann es als Lösungsmittel für geladene Teilchen, wie Ionen, oder andere polare Stoffe, wie Zucker, verwendet werden. Wassermoleküle bilden hierbei eine Hydrathülle.
Hydratation bezeichnet die Anlagerung von Wasser an gelösten Ionen oder an neutralen, polaren Molekülen.
Als Hydrathülle wird die sich hieraus ergebene Sphäre von Wassermolekülen um den gelösten Stoff bezeichnet.
Dieses Verhalten ist mit dem Dipolmoment des Wassers zu erklären. Bei gelösten Ionen, wie z. B. Natrium, richten sich die Pole der Wassermoleküle aus und bilden eine Hülle. Über H-Brücken können sich noch weitere Moleküle anlagern und eine Sphäre um das Ion bilden.
 Abbildung 8: Hydrathülle um Natrium-Ion. Quelle: de.wikipedia.org
Abbildung 8: Hydrathülle um Natrium-Ion. Quelle: de.wikipedia.org
Auf ähnliche Weise wird eine Hülle um polare Stoffe gebildet. Hierbei wechselwirken allerdings nur Wasserstoffbrückenbindungen zwischen den Wassermolekülen und der gelösten polaren Verbindung.
Genaueres zur Hydratation kannst Du im Artikel “Hydratation” nachlesen.
Viskosität des Wassers
Die Viskosität des Wassers verändert sich allerdings durch die Lösung von Stoffen. Bspw. nimmt die Viskosität des Wassers ab, je mehr Zucker gelöst wird. Wie und ob die Viskosität sich ändert, hängt allerdings von der Art und der Konzentration des gelösten Stoffes ab.
Viskosität beschreibt die Zähflüssigkeit von Flüssigkeiten und Gasen. Je niedriger die Viskosität ist, desto dünnflüssiger ist der Stoff, bspw. bei Benzin. Je höher die Viskosität, desto zähflüssiger ist der Stoff, bspw. bei Honig.
Biologische Bedeutung von Wasser als Lösungsmittel
Bäume können dank der Kohäsions- und Adhäsionseigenschaft Wasser in die Blätter transportieren. Hierbei werden ebenso Mineralien oder auch gespeicherter Zucker aus den Wurzeln entzogen. Dies wird erst durch die Eigenschaft des Wassers als Lösungsmittel ermöglicht.
Wasser Biologie - Säure und Base
Eine wichtige Eigenschaft des Wassers ist die Autoprotolyse.
Die Autoprotolyse des Wassers beschreibt die eine Gleichgewichtsreaktion des Wassers mit sich selbst.
Dabei entstehen aus zwei Wassermolekülen (H2O) ein Oxonium-Ion (H3O+) und ein Hydroxid-Ion (OH-).
Andere, veraltete, aber dennoch verbreitete Namen für Oxonium sind Hydroxonium und Hydronium.
Die Formel der Autoprotolyse sieht wie folgt aus:
![]()
Hierbei musst Du beachten, dass nur ein sehr geringer Anteil des Wassers dieser Gleichgewichtsreaktion folgt. Da Wasser allerdings in Lebewesen in sehr großen Mengen vorkommt, ist dies üblicherweise vernachlässigbar.
Eine umfassendere Erklärung zur Autoprotolyse findest Du im Artikel “Autoprotolyse des Wassers”.
Anhand der Autoprotolyse kannst Du vielleicht bereits erkennen, dass Wasser sowohl Protonen aufnehmen, aber auch abgeben kann. Wasser kann als Säure und Base reagieren. Man nennt es daher amphoter.
Stoffe, die sich je nach Reaktionspartner unterschiedlich verhalten, nennt man amphoter.
Stoffe, die amphoter in Säure-Base-Reaktionen reagieren, nennt man Ampholyte.
Achtung! Verwechsle nicht amphoter mit amphiphil. Letzteres beschreibt einen Stoff, der sowohl hydrophil als auch hydrophob ist. Eine genauere Erklärung zu Säure-Base-Reaktionen kannst Du im Artikel “Brönsted Säure-Base-Theorie” finden.
Biologische Bedeutung von Wasser als Säure und Base
Da Wasser als Säure und Base reagieren kann, ist es in seiner Reaktionsfähigkeit äußerst vielfältig und kann in unterschiedlichsten Säure-Base-Reaktionen verwendet werden.
Wasser reagiert als Base (nimmt ein Proton auf) mit Salzsäure:
![]()
Wasser reagiert als Säure (gibt ein Proton ab) mit Ammoniak:
![]()
Wasser Biologie - Umweltfaktor
Wasser ist in beinahe allen wichtigen Kreisläufen und Prozessen – sei es geologisch oder biologisch – in unserer Umwelt zu finden. Den wichtigsten Beitrag und Voraussetzung für die Entstehung und Aufrechterhaltung von Leben stellt Wasser dar.
Wasser als Ausgangsstoff für das Leben
Nach heutigem Erkenntnisstand begann das Leben in Wasser. Es ist schwierig, Rückschlüsse zu ziehen auf Lebensweisen und Prozesse von Organismen, die bereits seit Milliarden von Jahren nicht mehr auf der Erde existieren und keine oder kaum nennenswerte direkte Spuren hinterlassen haben, wie z. B. in Form von Fossilien.
Allerdings gibt es noch wertvolle Informationsquellen: die Nachkommen. Insbesondere die Mechanismen der Energiegewinnung und -speicherung sind von hohem Interesse. Da diese Bestandteile für das Überleben des Organismus von entscheidender Bedeutung sind und waren, erfuhr die dazugehörige genetische Information im Vergleich zu anderen nur geringfügige Veränderungen.
Die ersten Lebewesen waren wohl chemotroph. Sie verhielten sich vielleicht sogar wie heutige Mikroorganismen an “Schwarzen Rauchern” in der Tiefsee. Diese nutzen Schwefelwasserstoff (H2S) und Kohlenstoffdioxid (CO2), um energiereiche organische Stoffe aufzubauen.
Chemotrophie beschreibt eine Art des Stoffwechsels von Lebewesen, die Energie erzeugen, indem sie chemische Reaktionen mit Stoffen aus ihrer Umgebung durchführen.
 Abbildung 9: Der schwarze Raucher “Kandela-bra”, Quelle: de.wikipedia.org
Abbildung 9: Der schwarze Raucher “Kandela-bra”, Quelle: de.wikipedia.org
Mehr über die Ernährung von Lebewesen ohne die Nutzung von Licht kannst Du im Artikel “Chemosynthese” finden.
Hiernach entstanden die ersten phototrophen Organismen. Diese ähnelten sehr wahrscheinlich heutigen Cyanobakterien und bauen aus Wasser (H2O) und Kohlenstoffdioxid (CO2) mittels Sonnenlicht energiereiche organische Substanzen auf, wie bspw. Glucose (C6H12O6).
Phototrophie beschreibt eine Art des Stoffwechsels von Lebewesen, die mithilfe von (Sonnen-) Licht energiereiche organische Substanzen aufbauen und nutzen.
Nachdem sich die Atmosphäre mit Sauerstoff, das ein “Abfallprodukt” der Photosynthese ist, angereichert hatte, konnte der häufige Sauerstoff für einen weiteren energiereichen Stoffwechselvorgang genutzt werden: die Zellatmung.
Die Zellatmung beschreibt die Energiegewinnung mittels der Oxidation von organischen Substanzen.
Bei einer Oxidation werden Elektronen an das Oxidationsmittel übertragen.
Die häufigste Form der Zellatmung ist heutzutage die aerobe. Hierbei ist Sauerstoff (O2) das Oxidationsmittel.
Es gibt allerdings auch die anaerobe Zellatmung, die andere Oxidationsmittel verwendet, bspw. Schwefel (S).
Wasser spielt in den biochemischen Prozessen der Lebewesen eine wichtige Rolle. Auf die eine oder andere Art und Weise ist Wasser beteiligt, sei es bspw. bei der Photosynthese, der Zellatmung, der Glykolyse oder bei dem Zitronensäurezyklus.
Die Anreicherung der Atmosphäre mit Sauerstoff ist aus einem weiteren Grund von großer Bedeutung:
Über Millionen von Jahren konnte sich in höheren Abschnitten der Atmosphäre Ozon (O3) bilden. Dieses verhindert, dass ein Großteil der Ultra-Violetten-Strahlung (UV-Strahlung) auf die Erdoberfläche trifft.
Diese hochenergetische Strahlung ist in großen Maße für Lebewesen gefährlich, da diese Abschnitte des Erbguts beschädigt und dadurch den Organismus.
Darum sollte man sich, wenn man hoher oder langer Dosis von Sonnenstrahlung ausgesetzt ist, mit Sonnencreme schützen. Anderenfalls kann das Erbgut von Zellen, insbesondere in der Haut, beschädigt werden, was wiederum zu Mutationen und letztlich zu bösartigen Krebs führen kann.
Ebenso ist Wasser für die Lebewesen wichtig, da es als Lösungsmittel genutzt werden kann. Damit erlaubt es bspw. Pflanzen Mineralien aus den Wurzeln in die Blätter und umgekehrt energiereiche organische Stoffe aus den Blättern in die Wurzeln zu transportieren.
Die hohe spezifische Wärmekapazität von Wasser wird zur Regulierung und zum Transport von Wärme genutzt. Bspw. reguliert der Körper mittels Schwitzen die Wärme des Organismus. Ebenso transportiert er warmes Blut aus dem Brustkorb in die Glieder, z. B. in kalte Hände im Winter.
Bedeutung von Wasser in Ökosystemen
Ökosysteme, die auf dem Land zu finden sind, sind fundamental abhängig von dem Zugang zu Wasser. Wasser, das in Form von Niederschlag auftritt und in Seen und Flüssen gespeichert und verteilt wird, ist ein essenzieller Bestandteil zur Aufrechterhaltung der Lebensfunktionen. Ohne Wasser scheint kein Leben entstehen oder überdauern zu können.
Im Meer hingegen, in dem Wasserzugang keine Rolle spielt, ist der Zugang zu Nährstoffen entscheidend. Dies ist eindrücklich erkennbar an der Nutzung des Begriffs der “Wüste”: Eine Wüste am Land, wie z. B. die Sahara, zeichnet sich vor allem durch einen Mangel an Wasser aus. Im Meer hingegen hat eine “Wasserwüste”, wie Regionen der Tiefsee, schier endlos Wasser, aber kaum Nährstoffe.
Die Rolle des Wassers für das Klima
Wasser bildet die Basis für mildere klimatische Verhältnisse in allen Teilen der Erde. Beinahe alle Phänomene des Wetters treten aufgrund von Wasser überhaupt in Erscheinung. Der Grund ist vordergründig die spezifische Wärmekapazität und Bewegung von Wassermassen.
 Abbildung 10: Eine Superzelle, Quelle: de.wikipedia.org
Abbildung 10: Eine Superzelle, Quelle: de.wikipedia.org
Große Wassermassen, wie Ozeane, fangen die Energie des Sonnenlichts auf. Infolgedessen verdunstet eine große Menge von Wasser. Andere im Wasser gelöste Stoffe hingegen, wie Salz, verdunsten nicht. Da in den Regionen um den Äquator deutlich mehr Sonnenlicht auftrifft und deswegen mehr Wasser verdunstet, entsteht ein Konzentrationsunterschied der gelösten Stoffe in den Meeren. Dadurch entstehen große Meeresströmungen, die ganze Kontinente umfassen.
Für Europa ist insbesondere der Golfstrom von Bedeutung. Dieser transportiert warmes Wasser aus dem äquatorialen Atlantik über die Karibik nach Europa. Ohne diesen würden arktische Verhältnisse in Mitteleuropa herrschen.
Wasser bildet auch einen fundamentalen Beitrag zum Treibhauseffekt. Wasserdampf ist das häufigste Treibhausgas in der Atmosphäre. Ozeane wiederum speichern andere Treibhausgase, wie CO2, wodurch die Konzentration in der Atmosphäre massiv gesenkt wird. Im Zuge der Erwärmung des Planeten steigt die Temperatur auch in den Meeren an. Dies führt einerseits zu mehr Wasserdampf in der Atmosphäre. Andererseits sinkt auch die Fähigkeit der Ozeane CO2 aufzunehmen, was ebenso freigesetzt wird.
Mehr zur Erderwärmung und der Rolle von Wasser darin kannst Du im Artikel “Klimawandel” erfahren.
Wasser und der Mensch
Für jeden Organismus auf der Erde ist Wasser von existenzieller Bedeutung, insbesondere auch für den Menschen.
Die Bedeutung von Wasser für die Gesundheit des Menschen
Wasser spielt für die Gesundheit auf zwei Arten und Weisen eine wichtige Rolle:
Einerseits besteht der menschliche Körper zum Großteil aus Wasser (knapp 70 Prozent). Darum benötigt der Mensch mehrere Liter Wasser pro Tag, um zu überleben. Wassermangel führt in kürzester Zeit zu Schwindelgefühlen, Durchblutungsstörungen und Muskelkrämpfen. Die Versorgung von Muskeln mit Nährstoffen und Sauerstoff ist geschwächt und kann bis zum Versagen der Herzkreislaufsysteme führen.
Andererseits ist Wasser wichtig für die Gesundheit in Form von Hygiene. Die Reinigung von Haut, Mund und anderen äußeren Teilen des Körpers beugt der Infektion mit Fremdkörpern und Erregern vor. In Regionen mit akutem Wassermangel tritt dieser Aspekt häufig in den Hintergrund, weswegen die Infektionsgefahr deutlich erhöht ist.
Trinkwasserversorgung
Da Wasser vom Menschen täglich in großen Mengen aufgenommen werden muss, ist die Versorgung der Bevölkerung mit Wasser eine primäre Aufgabe von Gesellschaften. Je nach geographischer Gegebenheit kann die Wasserversorgung der Bevölkerung Schwierigkeiten mit sich bringen.
Vorkommen von Wasser auf der Erde
Wasser findet sich zum Großteil (knapp 97 Prozent) in den Meeren wieder. Dieses kann allerdings aufgrund des hohen Salzgehalts nicht getrunken und kaum für landwirtschaftliche Zwecke genutzt werden.
 Abbildung 11: Wasserverteilung auf der Erde, Quelle: de.wikipedia.org
Abbildung 11: Wasserverteilung auf der Erde, Quelle: de.wikipedia.org
Darum muss man auf die verbleibenden Ressourcen in Form von Süßwasser (knapp 3 Prozent) zurückgreifen. Diese sind allerdings (noch) zu mehr als zwei Drittel in Eiskörpern, wie Gletschern und den Polarkappen, gespeichert. Dies erschwert den Zugang.
Mit lediglich einem Prozent des gesamten Wassers auf der Erde werden die terrestrischen Ökosysteme versorgt. Nur 0,3 Prozent des gesamten Wassers auf der Erde steht als Trinkwasser für den Menschen zur Verfügung.
Süßwasserknappheit
Knapp zwei Drittel der gesamten Weltbevölkerung haben für mindestens einen Monat pro Jahr nicht ausreichend genug Wasser. Dies umfasst mehr als vier Milliarden Menschen. Darüber hinaus wird aufgrund der Urbanisierung die Knappheit von Wasser auf dem Land drängender. Auch steht die Bevölkerung und die Industrie immer mehr in Konkurrenz zueinander.
Mehr zur Entwicklung der Weltbevölkerung und der Urbanisierung kannst Du im Artikel “Bevölkerungsentwicklung und Urbanisierung” nachlesen.
Der Klimawandel sorgt für Wassermangel, wie bspw. in Ostdeutschland, was zu signifikanten Ernteausfällen führt. Andererseits verursacht er massive Regenfälle und Überschwemmungen, wie bspw. die Hochwasserkatastrophe in Westdeutschland in Nordrhein-Westfalen im Ahrtal.
 Abbildung 12: Hochwasserkatastrophe in Erfstadt-Blessem am 15. Juli 2021, Quelle: faz.net
Abbildung 12: Hochwasserkatastrophe in Erfstadt-Blessem am 15. Juli 2021, Quelle: faz.net
Der zuspitzende Kontrast zwischen schwerer Wasserknappheit auf der einen und den Überschwemmungen auf der anderen Seite führt zu immer mehr und schwerwiegenden humanitären Katastrophen.
Wasser in der Wirtschaft
Wasser wird in vielfacher Weise in jeglichen industriellen Zweigen genutzt. Sei es im Transportwesen bei Güterschiffen, in der Fischerei, beim Wärmetransport, der Erzeugung und Speicherung von Energie oder im Anbau und Zucht von landwirtschaftlichen Produkten. Letztere beiden werden im Folgenden genauer betrachtet.
Wasser in der Energiewirtschaft
Talsperren und Staudämme mit angrenzenden Wasserkraftwerken werden zur Erzeugung von Energie verwendet und stellen hierbei, im Gegensatz zu Kohlekraftwerken, eine nachhaltige und vergleichsweise umweltschonende Methode dar.
Die hohe spezifische Wärmekapazität und Verdampfungswärme von Wasser wird auch in anderen Kraftwerken verwendet. In Atomkraftwerken bspw. wird Wasser durch radioaktives zerfallendes Material erhitzt. Der entstehende Wasserdampf treibt wiederum eine Turbine an und erzeugt Strom.
 Abbildung 1: Ein Atomkraftwerk in Betrieb
Abbildung 1: Ein Atomkraftwerk in Betrieb
Wasser in der Landwirtschaft
Wasser wird sowohl im Ackerbau als auch in der Viehzucht in substanziellen Mengen benötigt. Knapp 70 Prozent des Wassers aus Grundwassern und Gewässern wird weltweit zur Bewässerung benutzt. Aufgrund des Klimawandels wird der Zugang zu Süßwasser immer knapper. Insbesondere Entwicklungsländer, die hauptsächlich auf die Produktion landwirtschaftlicher Erträge angewiesen sind, leiden unter dieser Entwicklung.
Wasser – Das Wichtigste
- Wasser ist eine chemische Verbindung aus Wasserstoff (H) und Sauerstoff (O).
- Wasser besitzt eine Vielzahl von bedeutsamen Eigenschaften für das Leben:
- Wasser ist die Bedingung zur Entstehung und Aufrechterhaltung von Leben.
- Der Mensch benötigt täglich enorme Mengen von Wasser, insbesondere zur Trinkwasserversorgung und zur Nutzung in Land- und Forstwirtschaft. Der Zugang und die Versorgung mit Süßwasser wird allerdings von Jahr zu Jahr schwieriger.
Nachweise
- Abb. 2: Wasserstoffbrückenbindung zwischen zwei Wassermolekülen (V) von Roland.chem ist unter der LizenzCC0 1.0
- Abb. 5: Gulf stream map (https://commons.wikimedia.org/wiki/File:Golfstream.jpg) von RedAndr ist unter der Lizenz CC 4.0
- Abb. 6: Manche Wassertropfen auf der Wand eines Blattes von Jonas Becker (https://commons.wikimedia.org/w/index.php?curid=59413425) ist unter der Lizenz CC 4.0.
- Abb. 8: Solvatisierung von Na+ durch Wasser (https://de.wikipedia.org/wiki/Datei:Na%2BH2O.svg) von Taxman ist gemeinfrei, weil sie nur Allgemeingut enthält und die nötige Schöpfungshöhe nicht erreicht.
- Abb. 9: Der schwarze Raucher "Kandelabra" in 3.300 Meter Wassertiefe im Logatchev Hydrothermalfeld am Mittelatlantischen Rücken (https://de.wikipedia.org/wiki/Datei:MARUM_Schwarzer_Raucher.jpg) von Marum (Universität Bremen) ist unter der Lizenz CC 4.0 international.
- Abb. 10: Superzelle (https://commons.wikimedia.org/wiki/File:Chaparral_Supercell_2.JPG) von Greg Lundeen ist gemeinfrei.
- Abb. 11: Wasserverteilung auf der Erde (https://commons.wikimedia.org/wiki/File:Wasserverteilung_auf_der_Erde.png) von USGS ist gemeinfrei.
- Abb. 13: nuclear power station in Tihange, Belgium (https://www.flickr.com/photos/62972007@N08/6569096441) von Andreas Krischer ist unter der Lizenz CC BY-ND 2.0.
Ähnliche Themen in Biologie
Verwandte Themen zu Ökologie




















