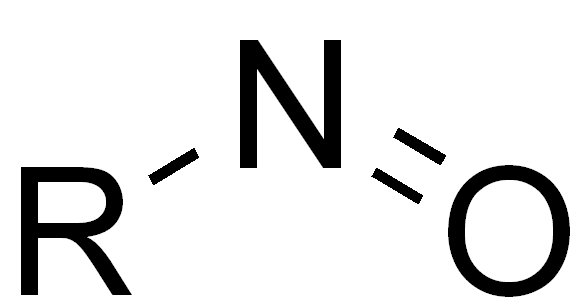In der Regel wird die Farbigkeit eines Farbstoffes oder eines Chromophors durch Absorption erzielt. Damit Einzelteile oder Gruppen eines Moleküls Licht absorbieren können, müssen anregbare Elektronen vorliegen, die die Energie des Lichtes aufnehmen können. Anregbare Elektronen liegen in Molekülen in folgender Form vor:
- In organischen Molekülen: konjugierte Doppelbindungen
- In anorganischen Molekülen: Elektronen der inneren Elektronenschale oder Farbigkeit durch Charge-Transfer-Übergänge
Auch wenn Farbstoffe UV-Licht absorbieren und somit nicht farbig wahrgenommen werden, spricht man von Chromophoren in den Molekülen.
Chromophor – Organische Chemie
Organische Farbstoffe bestehen in der Regel aus Chromophoren, die viele konjugierte Doppelbindungen (oft auch π-Bindungen) enthalten. Dabei führt die Absorption von Licht bestimmter Wellenlängen durch die Chromophore nach der Molekülorbitaltheorie zu einem Übergang der Elektronen von dem energetisch höchsten besetzten Molekülorbital (HOMO) zu dem energetisch niedrigsten unbesetzten Molekülorbital (LUMO). Je länger das System aus konjugierten Doppelbindungen ist, desto weniger Energie wird für diesen Übergang benötigt.
Es gibt einige Chromophore, die in der organischen Chemie typisch sind und oft auftreten. Diese findest du in der folgenden Tabelle:
| Name des Chromophors | Struktur |
Azo-Gruppe | 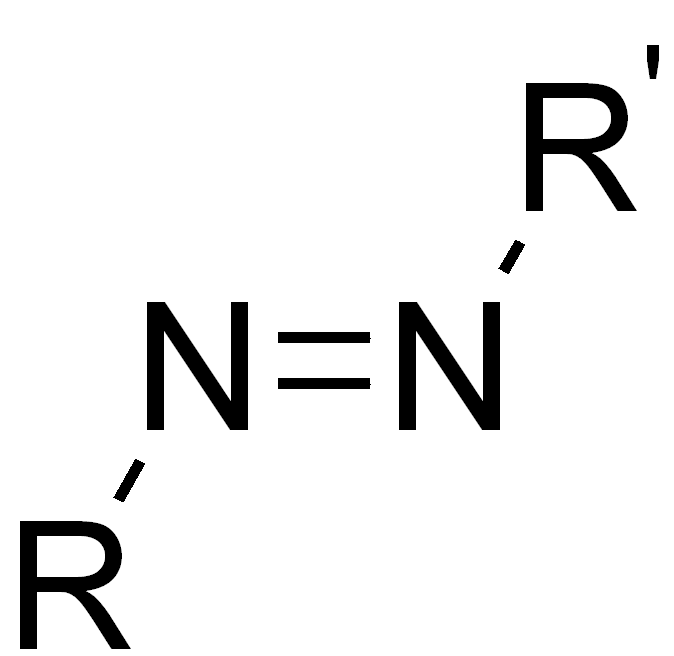 |
| Carbonyl-Gruppe | 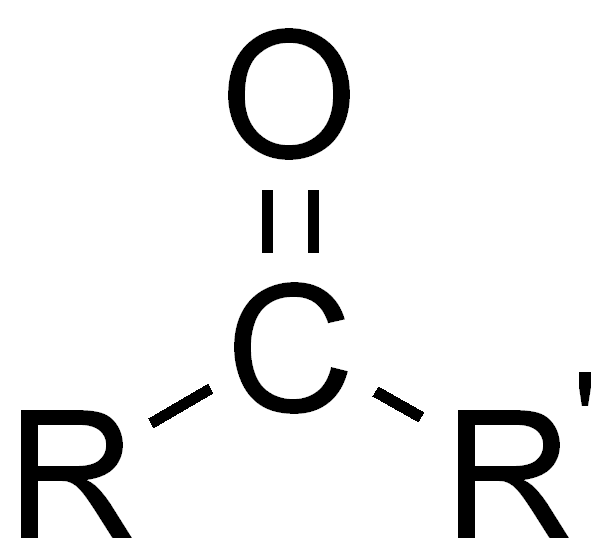
|
| Nitroso-Gruppe | 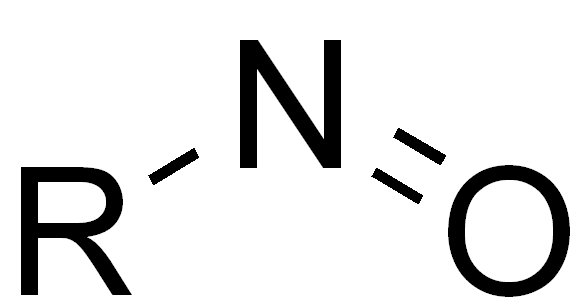
|
| Nitro-Gruppe | 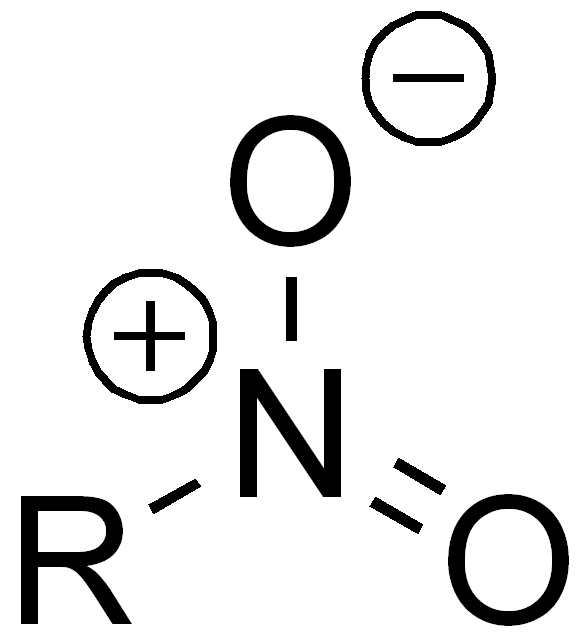
|
| Chinoide-Systeme | 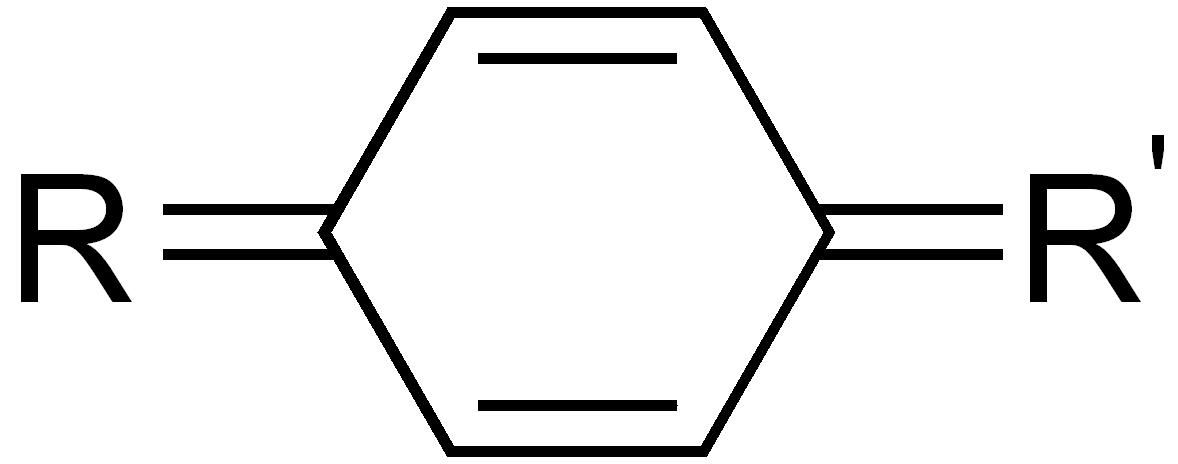
|
| Lange Ketten aus konjugierten Doppelbindungen (Polyene) | 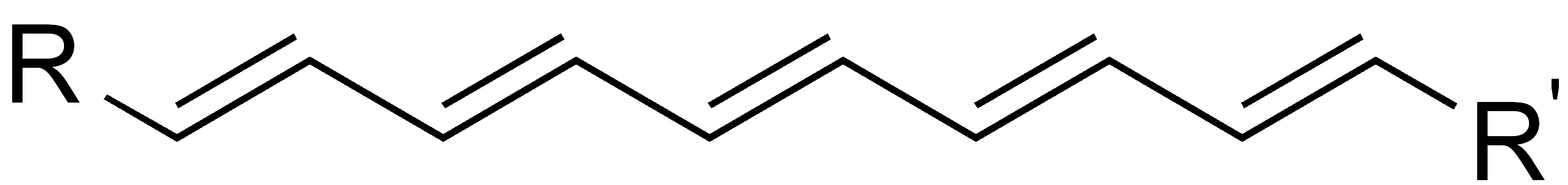
|
Das R steht hierbei für einen beliebigen organischen Rest. R' bedeutet dabei, dass dies ein anderer Rest sein kann. R könnte also im einfachsten Fall Wasserstoff sein, aber auch eine Alkylkette oder komplexere organische Verbindungen bezeichnen.
Oftmals sind organische Farbstoffe nach ihren Chromophoren benannt. Zum Beispiel die Azofarbstoffe, die nach der Azo-Gruppe benannt sind.
Wenn du nun ein Molekül siehst, dass eines dieser Chromophore enthält, bedeutet das, dass hier Licht absorbiert werden kann. Wenn in dem Molekül viele dieser Chromophore oder ähnliche Gruppen miteinander verknüpft sind, ist die Wahrscheinlichkeit zusätzlich sehr groß, dass die Verbindung farbig erscheinen wird.
Interessant ist hierbei, dass Aromaten in der Regel trotz ihrer starken Konjugation und der Ähnlichkeit zu den anderen Chromophoren farblos sind, also kein sichtbares Licht absorbieren.
Halte dir hierfür folgendes vor Augen: Aromaten sind eine besonders stabile Gruppe im Vergleich zu anderen konjugierten Verbindungen. Das heißt, dass sie nicht sonderlich reaktiv sind und daher auch nicht gut durch Absorption von Licht angeregt werden können. Bei stabilen Verbindungen wäre dafür mehr Energie nötig, als das sichtbare Licht zur Verfügung stellen kann.
Oftmals können sie dennoch UV Licht absorbieren. Werden an Aromaten gezielt Chromophore angebracht, können sie trotzdem sehr gut als Farbstoffe agieren und auch langwelliges Licht absorbieren.
Bei der Entwicklung von Farbstoffen wird versucht, möglichst viele Chromophore mit konjugierten Doppelbindungen in einem Molekül zu verknüpfen. Werden viele organische Gruppen oder organische Chromophore mit konjugierten Doppelbindungen verbunden, kann eine intensive Farbigkeit sichergestellt werden und eine Absorption von langwelligem Licht.
Abhängigkeit von der chemischen Umgebung
Doch warum wechselt dein Indikator eigentlich die Farbe, wenn du Säuren oder Basen dazu gibst? Die Antwort ist simpel: Die durch die Chromophore ausgelöste Farbigkeit eines Farbstoffes ist ebenfalls von der chemischen Umgebung, wie dem pH-Wert, abhängig. Hierbei kann eine Protonierung an dem Indikator, der also nichts anderes ist als ein einfacher Farbstoff, dazu führen, dass die konjugierten Doppelbindungen des Chromophors unterbrochen werden und der Farbstoff seine Farbigkeit verliert.
Wie so eine Reaktion aussieht, siehst du hier an Methylorange, einem häufig verwendeten Indikator, in seiner Protonierungsreaktion:
 Abbildung 1: Protolysegleichgewicht von Methylorange (links basisch, rechts sauer)
Abbildung 1: Protolysegleichgewicht von Methylorange (links basisch, rechts sauer)Links ist es die Azo-Gruppe, die wahrscheinlich durch die Konjugation mit den aromatischen Ringen, gelborange erscheint. Wird diese nun durch Zugabe von Säure protoniert, erhält man die rechte Form, die eine chinoide Gruppe beinhaltet. Die protonierte Form ist stattdessen nur rot, daher der Farbumschlag, der bei pH-Werten von 3,0 bis 4,4 zeigt.
Vorhersage der Absorptionsmaxima eines Stoffes mithilfe der Chromophore
Stoffe, die Licht absorbieren, erscheinen stets in der Komplementärfarbe, der am stärksten absorbierten Farbe des Lichtes. Diese Absorptionsmaxima in Spektren sind also besonders wichtig für die Kenntnis über die Farbigkeit eines Farbstoffes. Siehst du nun eine Strukturformel eines organischen Farbstoffes, ist es schwierig zu sagen, welche Farbe der Farbstoff tatsächlich hat.
Hierfür gibt es einen Trick, sogenannte Inkrementsysteme. Das sind Tabellenwerke, die einzelne organische Chromophore, Molekülteile und andere organische Gruppen beinhalten und für jede davon einen Wert für eine absorbierte Wellenlänge darstellen.
In der Realität ist es so, dass, solange keine komplexen Wechselwirkungen vorliegen, die absorbierten Wellenlängen aus diesen Inkrementen für alle Chromophore in dem Farbstoff addiert werden können. Bis auf ein paar Nanometer erhalten diese genaue Ergebnisse für das Absorptionsmaxium eines Farbstoffes. Somit kann die absorbierte Wellenlänge des Lichtes vorhergesagt werden.
Chromophor – Anorganische Chemie
In der anorganischen Chemie rührt die Farbigkeit von Chromophoren von der Anregung der inneren Elektronenschale durch Licht oder von Charge-Transfer-Übergängen her. Hierbei zeigen besonders oft Ionen aus den Nebengruppen Farbigkeit. Wenn es um Chromophore in farbigen Mineralen geht, wird zwischen zwei Arten von Mineralen unterschieden:
- Idiochromatische Stoffe: Das Chromophor ist direkt am Aufbau des Minerals beteiligt, wie bei festem Kupfersulfat mit Kristallwasser.
- Allochromatische Stoffe: Das Chromophor ist nur in Spuren im Kristall vorhanden, wie beispielsweise bei Rubinen oder Saphiren. Beide bestehen aus Korund (Al2O3) und enthalten in Spuren Ionen von Nebengruppenelementen, die entweder zur blauen Farbigkeit des Saphirs (Fe2+ und Ti4+ oder Co2+) oder zur roten Farbigkeit des Rubins (Cr3+) beitragen.
Chromophor - Das Wichtigste
- Ein Chromophor ist das Einzelteil eines Farbstoffes, das Licht absorbiert, reflektiert oder streut und somit dem Molekül Farbe verleiht.
- Chromophore in der organischen Chemie sind in der Regel Gruppen aus großen durchkonjugierten π-Systemen.
- Wichtige Chromophore in der organischen Chemie sind:
- Azo-Gruppe
- Carbonyl-Gruppe
- Nitroso-Gruppe
- Nitro-Gruppe
- Chinoide Systeme
- Polyene.
- Die Farbigkeit eines Chromophors kann durch die chemische Umgebung, wie dem pH-Wert, beeinflusst werden.
- Die Farbigkeit eines Farbstoffes kann durch Inkrementsysteme aus den Chromophoren des Farbstoffes grob vorhergesagt werden.
- Chromophore in der anorganischen Chemie sind in der Regel Teilchen mit einer anregbaren inneren Elektronenschale oder Charge-Transfer-Übergängen.
- Bei dem Aufbau von Chromophoren in Mineralen wird zwischen zwei Arten von Mineralen unterschieden:
- Idiochromatische Stoffe: Das Chromophor ist am Aufbau des Minerals beteiligt.
- Allochromatische Stoffe: Das Chromophor ist in Spuren vorhanden.